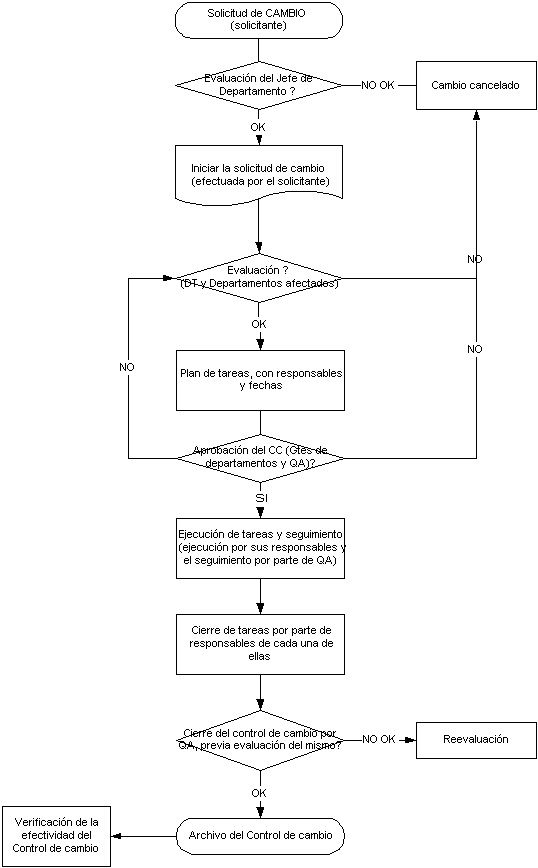
De acuerdo a las cGMP:
Todo el personal debe ser consciente de los principios GMP que les afectan, y además recibir formación inicial y continua sobre GMP en relación con sus responsabilidades laborales.
Normalmente nos preguntamos sobre cuál es el público objetivo de un curso o de un SOP que destinamos para su lectura y comprensión.
Es de suma importancia encontrar una relación entre el trabajo y las normas, de manera de hacer las asignaciones de manera apropiada.
El segundo punto al que quiero referirme tiene que ver con un tema que ya hemos mencionado, la eficiencia del entrenamiento, aquí podemos observarlo en la palabra conciencia, para que el entrenamiento sea efectivo, es de suma importancia que lleguemos a los entrenados (receptores) de una manera clara, que ellos puedan ver la importancia de las GMP en su labor diaria.
Pero ¿Por qué hablamos de una formación continua?, si alguno de Uds. Ha practicado un deporte, recordará la importancia de la repetición sobre todo al comienzo del aprendizaje para que un gesto se vaya incorporando, esto no es la excepción, es algo así como las lecciones aprendidas durante los primeros años de vida, clases en todos lados, en la escuela, en la casa, en el club, etc.
¿Cuántas veces se nos dijo “No cruces la calle corriendo” antes de que fuera grabado en realidad en nuestro cerebro? Por cierto muchas, y esto no es muy distinto cuando nos referimos a los adultos.
¿Qué significa continua?, ¿anual, cada dos años? Yo diría que anual está muy bien, ya que no solo debemos capacitarlo sino también debe existir tiempo para la reflexión sobre lo aprendido e integrar los conceptos al trabajo.
Ahora cuando decimos relacionados con sus actividades o responsabilidades laborales, estamos intentando que cada puesto de trabajo tenga la DOSIS de GMP que necesita, seguramente será distinta para el Departamento de Ingeniería que para el de Control de Calidad o el Depósito.
La mayoría de los operadores tiene un conocimiento más profundo de su tarea que de las cGMP. ¿Qué pasaría si intentamos aumentar el nivel de conciencia de las GMP de nuestros colegas en los próximos años? Sólo con el objetivo de conectar detalles de sus operaciones diarias y la razón de ser de las GMP.
Por último quiero mencionarles algo sobre la forma que llegamos con el concepto a nuestro equipo. Es muy importante intentar abordar la enseñanza desde distintas formas, ya que algunos prefieren las clases presenciales con sus debates intensos, otros quizás la lectura o las capacitaciones de e-learning (aquí la persona maneja sus tiempos, el lugar, etc.) con las opciones de consulta sobre las dudas que puedan surgir, etc. Es obvio que no podemos dar una clase cubriendo las expectativas de todos los asistentes, pero quizás podamos satisfacer a la mayoría si manejamos un abanico de opciones.
Pienso que debemos buscar la concientización de cada uno de los empleados, colegas sobre la importancia de nuestra actividad, la cual finalmente quiere proteger al consumidor de los medicamentos, que somos nosotros.
Un ejercicio muy útil es darle a un grupo de empleados de su compañía farmacéutica una copia de las normativas y debatan sobre el impacto de las mismas sobre su labor diaria, se sorprenderá de los resultados.
Les aconsejo que planifiquen entrenar a su grupo en las GMP a conciencia, no para cumplir el número un plan regulatorio o el número de horas que nos solicita la Casa Matriz, sino a conciencia, educar sobre el papel y la importancia de nuestra industria.
Espero que les haya resultado interesante.
Les dejo un link a nuestro blog (https://blog.cgmpdoc.com/) donde podrán encontrar algunos artículos de interés.
En nuestra página www.cgmpdoc.com podrá encontrar talleres “In Company” y cursos a su medida.
(*) Repaso de entrenamiento
Es una buena práctica para proporcionar actualizaciones regulares de capacitación al personal sobre los aspectos claves de su actividad.
Nota: un programa de revisión periódica de la calificación del personal que trabaja en áreas estériles / asépticas debe ser aprobado, el mismo debe considerar las buenas prácticas de elaboración en las áreas limpias y estériles y el correcto uso de la vestimenta.