Aún en empresas con exitosos programas de calidad, minimizar el error humano es un desafío difícil.
A pesar de la conciencia de la importancia de los errores humanos, aún no hemos dado con la dirección correcta para su corrección y generalmente la respuesta a una situación de error humano es el reentrenamiento.
Sin embargo los estudios han demostrado que en un bajo porcentaje (aprox. 10 %) la falta de entrenamiento es la causa raíz del error humano. Ahora claro Uds. se preguntarán cual es la causa?
Veamos un poco más en detalle.
El control de error humano se realiza 80 por ciento en la gestión
sistemas, los cuales facilitan el trabajo y un 20 por ciento por la gestión de personas, trabajando sobre hábitos, comportamientos.
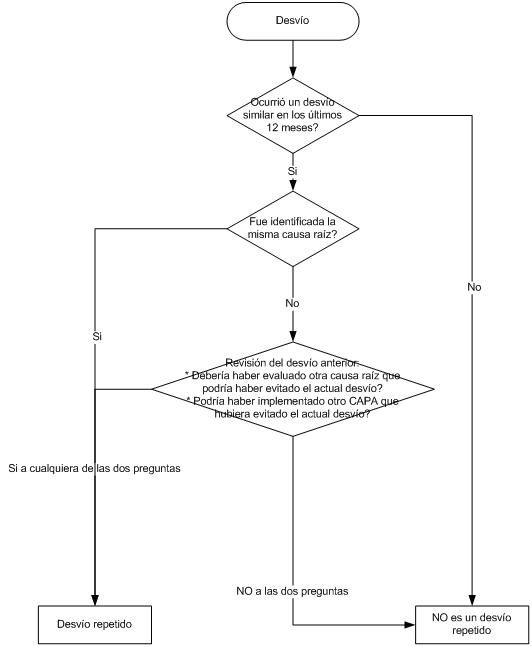
Una vez que la investigación de la causa raíz se ha completado, se inicia una nueva investigación: la del error humano, les dejo el link al artículo anterior conteniendo el check list y la herramienta: 5 porqués.
Las acciones correctivas y preventivas son la clave para el fortalecimiento de los Sistemas de calidad.
Entrenar o, más específicamente, reestrenar es menudo utilizado como una medida correctiva en la industria farmacéutica. Sin embargo, en lugar de ayudar, puede conducirnos a una situación peor.
Veamos este ejemplo:
Su televisor no está funcionando de forma correcta, razón por la cual llama al service, el mismo llega a su casa y sin siquiera mirar el TV ni preguntarle nada a Ud. Sobre que falla hace, le indica que compre un cable de conexión y lo reemplace por el que tiene. Le cobra X pesos y se retira. Parece loco, no?
Sin embargo, eso mismo es lo que sucede cuando tomamos acciones sin conocer la verdadera causa raíz del error.
El reentrenamiento debería hacerse para corregir un problema, por ejemplo en el caso que lleguemos a la conclusión que el entrenamiento original no fue totalmente efectivo, claro que deberíamos luego ver porque no lo fué.
Si Ud. le da un vistazo al check list del artículo anterior podrá ver que no hemos eliminado la posibilidad de reestrenar al personal, pero es una de ellas, no la única razón.
El Análisis de Causa Raíz (RCA) es un método de investigación paso a paso
que utiliza distintas herramientas (ver al final del artículo).
Las investigaciones deben llevarse a cabo a fondo para llegar a explicar lo que paso y porqué, con el objetivo principal de estar seguros que no vuelva a suceder.
A primera vista, un acontecimiento adverso puede parecer que fue causado por una falla humana, pero las investigaciones frecuentemente revelan que hay una cuestión mucho más profunda que causó la misma.
Claro, que no todos los problemas o desvíos requieren una investigación hasta el nivel de causa raíz. Estas investigaciones en profundidad pueden ser muy costosas, y la necesidad de ellas variará para cada organización.
Si un evento tiene consecuencias relativamente menores, una organización no va a aprender mucho de realizar un análisis de causa raíz (RCA). Las empresas
necesitan determinar la gravedad de un problema, la frecuencia con que se produce, cómo afecta a la empresa, etc. Estas respuestas ayudarán a determinar si es necesario efectuar una investigación de causa raíz.
Si el factor causal no se trata, el problema no se resuelve. La mayoría de las organizaciones están en este nivel. Si el problema específico no se resuelve,
el problema se repite. Este nivel es a veces ignorado.
La mayoría de las organizaciones no tienen un programa de análisis de causa raíz.
Las causas fundamentales de un evento deben estar directamente conectadas con las medidas correctivas correspondientes. Si la alta dirección no
no ve una conexión entre la causa del evento y las recomendaciones de una investigación, es probable que no les de curso para su aplicación, y esto le ocasionará un alto costo a la organización.
Es muy importante que tengamos en cuenta que el análisis de causa raíz (RCA) no está destinado a ser utilizado como un proceso para fijar culpas o encontrar culpables, sino para permitir soluciones eficaces y prevenir la recurrencia de los eventos adversos. Las recompensas y desalientos, deberían ser parte del proceso normal de revisión de performance de las compañías.
Algunos expertos de la industria creen que debería haber un cambio en la forma que las compañías enfocan el tema de los errores humanos. La forma actual es evaluar las equivocadas decisiones de los empleados y su culpa. Un nuevo enfoque es considerar el error humano como un síntoma de un problema profundo dentro de un sistema. El error humano debería relacionarse menos con el empleado y más sobre porque la persona comete el error.
La gerencia debe asegurar que cada acción correctiva o preventiva que se toma, sea verificada como efectiva.
Todos estos procedimientos deben ser adecuadamente documentados.
Les dejo estos links de interés:
Espero que les resulte útil.