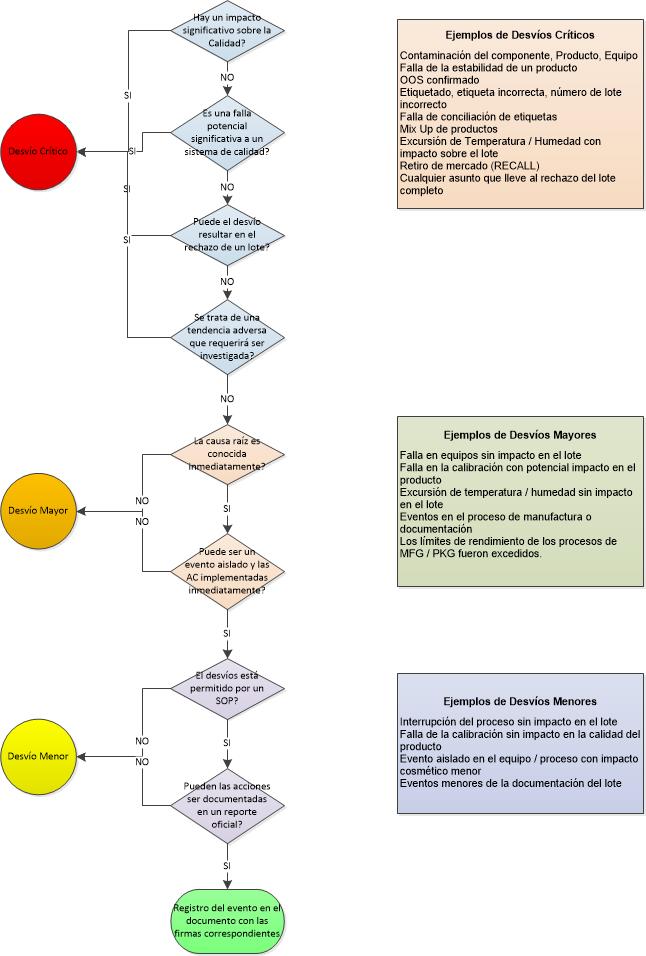
Esta es una manera relativamente simple de clasificar los desvíos de manera inmediata, generalmente esta actividad es realizada por Aseguramiento de Calidad, de forma de poder asignar los recursos de acuerdo a prioridades.
Se basa en una matriz de Impacto sobre la calidad y probabilidad de detección del desvío.
Impacto sobre la Calidad / GMP del desvío
- Efecto menor en el ensayo de calidad. Desvío GMP menor. Por ejemplo: falta de una firma no crítica.
- Efecto sobre un ensayo de calidad, desvío GMP
- Efecto grave sobre un ensayo de calidad, se trata de un desvío GMP serio, por ej. Resultado fuera del rango validado
- Riesgo al paciente o producto fuera del marco regulado. Desviación GMP crítica. Por ejemplo: Mix Up de producto confirmado. Ausencia de firmas en la carga de un material, en la liberación de una línea o falla en la conciliación.
Probabilidad de detección del desvío
- El desvío se detectará con certeza, es tan obvio que se detectará cuando se produce, o cerca de la ocurrencia.
- La desviación probablemente será detectada. Una desviación no necesariamente descubierta inmediatamente, pero normalmente más tarde; Por el operador, en la revisión o análisis de rutina.
- Existe el riesgo de que no se detecte la desviación. La desviación se descubrirá si usted es observador, pero no necesariamente descubierta en el proceso de revisión o análisis de rutina. La desviación podría ser descubierta mucho más tarde.
- La desviación probablemente no será detectada. Las formas rutinarias de trabajo no son suficientes para descubrir la desviación. El descubrimiento de la desviación es por casualidad.
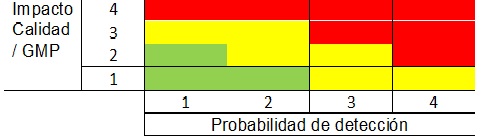
Las coordenadas en rojo, implican alto riesgo y por lo tanto el desvío se clasificará como crítico, en el caso de las celdas en amarillo, el riesgo es medio y el desvío recibirá la clasificación de mayor y por último las celdas en verde, corresponden a riesgos bajos y sus desvíos serán menores.