Archivo del December, 2015
Cómo evitar dolores de cabeza y ser exitoso. Algunas estadísticas indican que un elevado porcentaje de las observaciones regulatorias (30-40%) están relacionadas a los SOPs.
No necesariamente estamos hablando de la falta de ellos, sino que hay casos de SOPs mal escritos, no representan el proceso que están ejecutando, fallas en la comunicación, pobre entrenamiento, y falta de seguimiento y cumplimiento de los mismos.
En algunos laboratorios existen una serie de SOPs muy bien armados y que son utilizados para demostrar a los inspectores los sistemas de calidad, sin embargo los operadores, analistas del laboratorio no están en pleno conocimiento de dichos SOPs.
Pero, a no sentirse mal, Ud. Tiene la oportunidad de reparar esa situación. Porqué esperar a que un inspector la observe?.
Desde cGMPdoc le ofrecemos un curso “In Company” sobre cómo redactar SOPs para entrenar a su personal para:
- Crear SOPs claros y entendibles
- Actualizar sus SOPs de acuerdo a los requerimientos regulatorios
- Simplificar sus SOPs (uso de herramientas gráficas en lugar del texto)
- Identificar SOPs faltantes
- Administrar sus SOPs
- Diseñar Instructivos de trabajo
Si Ud. Es nuevo en el tema o si tiene experiencia, este entrenamiento le permitirá entender el proceso completo de la gestión de SOPs.
Cualquier duda o consulta, los esperamos en info@cgmpdoc.com.
Les dejo un link a un artículo: Redacción de SOPs en 8 pasos
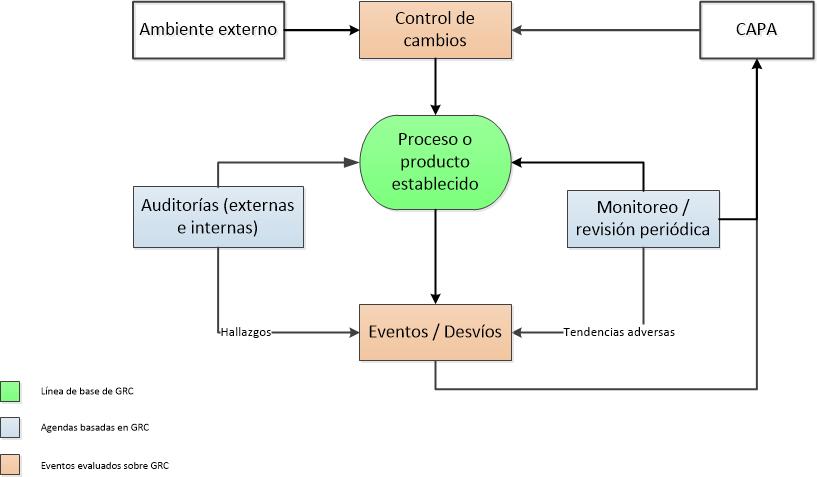
La calidad de los productos así como la salud y seguridad de los pacientes es lo más importante para todos los que trabajan en la elaboración y suministro de productos farmacéuticos.
Se debe contar con sistemas robustos y controles de calidad a través de toda la cadena para garantizar que cada producto cumple con todos los criterios de calidad aplicables.
Sin embargo, ¿Son suficientes estos sistemas y controles?
¡Cumplir no es suficiente!
El Cumplimiento requiere el fiel seguimiento de los lineamientos reglamentarios, los estándares y las políticas del laboratorio. Es la base de toda la operación y ejecución de calidad, sin embargo no garantiza la misma.
Disponer de SOPs, sistemas y controles no es suficiente!
¿Qué es una cultura de calidad?
Un ambiente donde cada persona entiende y reconoce su responsabilidad en proteger la calidad del producto y la seguridad del paciente. El laboratorio puede tener todos los SOPs, sistemas y controles requeridos, pero sin una cultura de calidad no podrá garantizar la calidad de los productos y la continuidad del negocio.
¿Cómo luce una cultura de calidad?
La Calidad se integra al proceso desde el principio. Los riesgos al elaborar y distribuir medicamentos de calidad se entienden y se mitigan adecuadamente. Las ejecuciones de las actividades son verificadas en tiempo real y si es necesario son efectuadas correcciones.
Se trata de una organización con deseo de resolver los problemas, compartir las lecciones aprendidas y con una clara idea de hacer las cosas bien a la primera vez. Los problemas se escalan según sea necesario y se resuelven en colaboración con las áreas involucradas. No hay señalamientos personalizados.
Las decisiones difíciles se toman en base a lo que es correcto y no lo que es necesario, aun cuando esto presente obstáculos para lograr los objetivos del negocio.
La calidad es responsabilidad de todos!
Lo crítico de la cultura de calidad, se trata de los comportamientos, no de SOPs ni de políticas.
Sin una cultura de calidad fuerte no se puede mitigar totalmente los riesgos en la manufactura y distribución de los productos. La cultura de calidad no se puede imponer por agentes externos ni tampoco se introduce con solo cambiar los sistema de calidad.
Responsabilidad de los líderes, ellos deben:
- Proveer los fundamentos necesarios para proteger la calidad.
- Crear un ambiente donde hacer las cosas correctamente y hacer lo correcto se valora por encima de la velocidad y el costo.
- Hacer del mejoramiento continuo una prioridad, que resulte en la necesidad de identificar y resolver problemas.
- Proclamar el valor de escalar los problemas y generar reportes de desvíos.
- Ayudar a los empleados a reconocer desvíos e implementar un proceso eficiente para su investigación.
- Establecer mecanismos de seguimiento a los desvíos y la publicación de métricas asociadas a los mismos.
- Modelar todos estos comportamientos!
Responsabilidad de todos los empleados, ellos deben:
- Seguir los procedimientos en todo momento.
- Realizar solo las tareas para las cuales han sido capacitados y Entender el porqué de las tareas que realizan.
- Preguntar o buscar ayuda si no entienden las instrucciones.
- Realizar las tareas correctamente en todo momento.
- Manejar toda documentación con prontitud y corrección.
- Seguir eficientemente la implementación de todas las acciones correctivas identificadas como resultado de desvíos, cambios, etc.
Importante:
Deben comunicar a su supervisor toda situación atípica, pueda o no ésta impactar la calidad de un producto.
Difúndalo, tal como les comenté en el artículo Las raíces de la cultura de calidad, este proceso lleva tiempo, por dicho motivo, no espere, empiece ya.