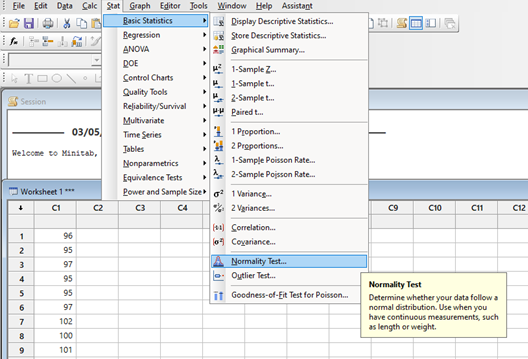
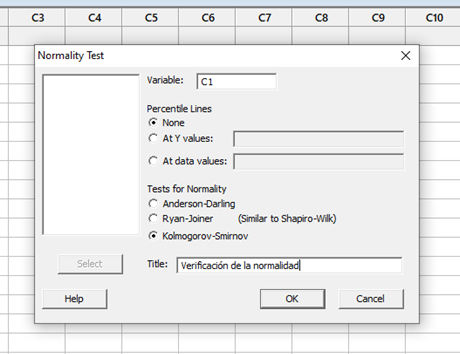
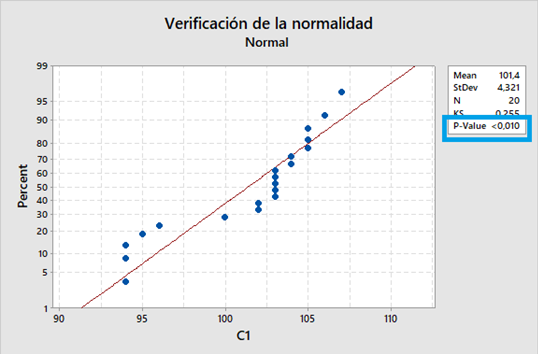
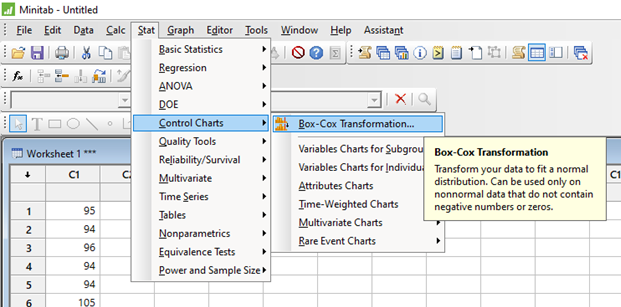
La industria todavía está esperando el nuevo Anexo 1 de la directriz GMP de la UE, y todavía se especula sobre el tiempo de implementación después de la publicación. La última información disponible es que una versión final probablemente esté con los organismos responsables de la Comisión Europea para su firma.
Pero eso no impide que la industria se prepare para la publicación. Ya podría leer sobre el nuevo requisito para una estrategia para las medidas de control de la contaminación definidas en el Anexo 1 revisado.
- Una pauta,
- Una plantilla,
- Un ejemplo de un análisis GAP y
- Una descripción general de documentos útiles y pautas oficiales
Y lo puso todo a disposición de todas las partes interesadas de forma gratuita.
Con base en la información actualmente disponible en el Anexo 1 y en algunas sugerencias y comentarios recibidos después de la publicación de la primera versión de la Guía de estrategia de control de la contaminación, el Anexo 3 de este documento de orientación ahora se ha revisado para que sea más claro y fácil de entender en algunos lugares.
Las actualizaciones más importantes de la Guía CCS Anexo 3
El Anexo 3 comprende la “Plantilla para el Documento de Estrategia de Control de Contaminación (ejemplo)”. Se han modificado los siguientes puntos:
- 0.2 Nuevo: Se recomienda que el documento CCS sea aprobado, revisado y actualizado de manera continua. Si corresponde, el documento podría incluirse en el Archivo Maestro del Sitio. Para una instalación en construcción o una importante renovación o desarrollo de una instalación, se debe considerar la utilidad de incluir el CCS en la documentación del proyecto.
- 1.1 Los Procesos: Actualización de la lista de posibles contenidos adecuados
- 1.2 General: Actualización de la lista de posibles temas
- 11 Validación del proceso: La nota sobre Validación de limpieza se ha movido de capítulo
- 13 Limpieza y Desinfección – Explicación actualizada
- 14.2.1 Medio ambiente: La explicación se ha complementado y aclarado.
- 16 Mejora continua en base a la información derivada de lo anterior: Se actualizó y complementó la explicación.
Si se publican versiones adicionales del Anexo 1 o del documento final, por supuesto, seguirán las actualizaciones.
También se puede encontrar más información y la descarga de la guía en el sitio web de la Fundación ECA