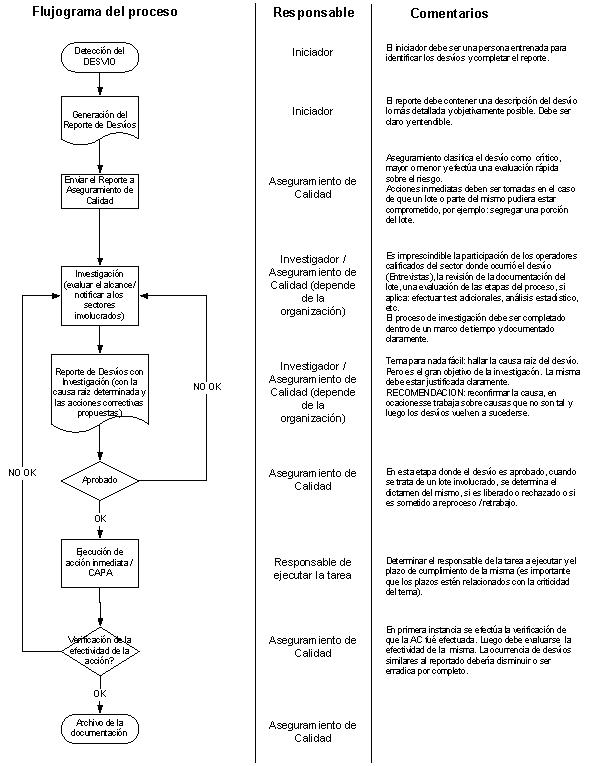
Quiero plantearles este caso. Seguramente Ud. han visto situaciones similares, pero me parece interesante reflexionar sobre ello.
Esta situación sucedió al final del turno noche de un día de semana, el operador José, quien está calificado en la posición, de forma apresurada limpió el equipo de granulación húmeda que utilizó durante su turno para una de las etapas de elaboración de un comprimido.
El procedimiento de limpieza es manual, y está validado, el mismo incluye el desarmado del equipo, el lavado con detergente, luego el enjuague con agua ablandada y el enjuague final con agua purificada. Por último el secado con aire comprimido.
Luego de completar la operación y llenar el registro de limpieza respectivo, José requirió que su supervisor firme el registro de limpieza para verificar que el equipo estaba limpio. El supervisor firmó el registro dando conformidad de la operación.
Al día siguiente, al iniciar las actividades, el operador del turno de la mañana, Carlos, notó que había varias zonas del equipo granulador lavado por José que no estaban limpias, observando polvo sobre distintas partes del equipo. La operación de manufactura no pudo ser iniciada, Carlos llamó a su supervisor de turno quién confirmó que el equipo NO estaba limpio.
Este es el hecho, sin embargo me pregunto?
- Si el equipo se limpió utilizando un SOP validado. ¿Por qué quedaron residuos?
- ¿Cómo es que a la noche fue verificado como limpio y a la mañana estaba sucio?
- ¿El operador José está adecuadamente entrenado?
- Por algún motivo ¿el equipo se ensució más de lo habitual haciendo que el SOP de limpieza sea inefectivo?
- ¿Fue seguido el SOP?
- ¿El residuo corresponde al producto elaborado o era otro material? ¿Podría haberse contaminado luego del turno por un inadecuado almacenamiento?
Entrevista con el personal
Todos los participantes del proceso fueron entrevistados.
José confirmó que nada raro ocurrió respecto de la limpieza del equipo, que el mismo no fue inusualmente sucio, que todas las etapas de limpieza fueron efectuadas como requiere el procedimiento.
Dado que era tarde, asume que la limpieza fue efectuada rápidamente siguiendo el SOP, quedando según el “suficientemente limpio” para la próxima elaboración. Podría haber habido algunas pequeñas manchas de residuos. Según José declaró que esta dentro de la responsabilidad del próximo equipo de manufactura hacer la limpieza final si algún residuo es hallado.
El supervisor de turno noche confirmó que todas las etapas del SOP de limpieza fueron efectuadas. El no tuvo tiempo para examinar a fondo el equipo después de la limpieza porque el turno de trabajo estaba pasado de horario y no están permitidas las horas extras para el management.
Además el estaba seguro que el equipo estaba limpio porque José es un buen trabajador y por eso firmó el registro de limpieza.
El operador de la mañana (Carlos) y su supervisor confirmaron que el equipo NO estaba limpio al examinarlo previo al inicio de la operación de MFG. Encontraron múltiples manchas con residuo blanco en varias partes del equipo. El residuo era claramente visible en el granulador.
Evaluaciones técnicas
Personal técnico revisó el SOP de limpieza y la documentación de validación de soporte.
El proceso es completamente manual y depende de la persona que efectúa la tarea.
El SOP utilizado fue idéntico al del proceso validado. No hubo desvíos o no conformidades u otros problemas respecto del SOP.
El SOP ha sido usado por años sin registros de problemas. Cuando el personal de Manufactura del turno mañana, notó el equipo sucio, personal técnico tomo muestras de hisopado de las manchas para determinar el tipo de residuo. Los resultados indicaron que trataba del activo del producto anterior a la limpieza.
¿Cuál piensan que fue la discusión? ¿Qué CAPAs se tomaron? y ¿Cuáles pueden haber sido las conclusiones de este evento?
Les dejo abierto el tema para debatir, esperando sus comentarios.
![Reporte_Investigacion[1]](http://blog.cgmpdoc.com/wp-content/uploads/2011/12/Reporte_Investigacion1.jpg)